Модульная организация механизмов ахроматическо зрения: от человека к простым нервным системам
Страницы: 92-99
Ключевые слова: ахроматическое зрение; беспозвоночные; ощущение яркости; электроретинограмма; оптический нерв; on- и off-системы зрения; «яркостный» и «темновой» нейронные модули
Шехтер М.С., Черноризов А.М., Гадельшина Д.Ф. (2010). Модульная организация механизмов ахроматическо зрения: от человека к простым нервным системам. Национальный психологический журнал, (2) , 92-99.
Скопировано в буфер обмена
СкопироватьАннотация
Работа посвящена проверке гипотезы о том, что модульный принцип организации механизмов ощущений яркости является универсальным в широком ряду животных, включая беспозвоночных. В статье излагаются результаты экспериментального исследования ахроматического зрения улитки Helix lucorum, полученные путем регистрации суммарной электрической активности сетчатки (электроретинограммы, ЭРГ) и оптического нерва.
Традиционно в качестве нейронного кода интенсивности света разными авторами рассматриваются такие параметры клеточных реакций, как частота импульсной активности, величина межимпульсных интервалов, распределение потенциалов действия во времени (паттерн реакции) (Батуев, Куликов, 1983; Николс и др., 2003; Смит, 2005). Существенным при этом является не тип предполагаемого кода, а тот факт, что при любой его разновидности для различения яркости, предположительно, достаточно участия одной, не разлагаемой далее на самостоятельные модули нейрональной системы. В данной работе рассматривается принципиально иной подход, связывающий механизмы различения яркости с активностью не одной, а двух независимых нейрональных систем — «яркостной» и «темновой», отвечающих на изменение освещенности одновременно, но противоположным (оппонентным) образом (Heggelund, 1974; Фомин, Соколов, Вайткявичус, 1979; Izmailov, Sokolov, 1991). Увеличение интенсивности света приводит к возбуждению яркостного и торможению темнового каналов, тогда как уменьшение освещения вызывает обратный эффект. При подобном оппонентном способе реагирования параметры ответов каждого из двух нейронных модулей («яркостного» или «темнового») утрачивают свое самостоятельное значение, и интенсивность света однозначно определяется только соотношением их активности. Такой способ кодирования интенсивности света получил название «векторного кодирования яркости» (Соколов, 2003).
Проверка гипотезы о векторном способе кодировании яркости была проведена психофизиологическими экспериментами с человеком, а также в поведенческих и нейрофизиологических опытах на животных (обезьяна, кролик, рыбы, лягушка, моллюск) (Соколов, 2003). С помощью методов многомерного шкалирования были построены двухканальные модели ахроматического зрения, которые имели вид двумерной сферы и для человека, и всех исследованных животных (Измайлов, Соколов, 1984; Зимачев и др., 1986; Измайлов, Исайчев, Шехтер, 1998; Измайлов и др., 2006; Черноризов, 1999, 2010; Черноризов и др., 2009).
В нейрофизиологии двумерность моделей ахроматического зрения человека и животных может свидетельствовать о том, что в различении ахроматических (яркостных) градаций освещения участвуют два оппонентных друг другу нейронных механизма, которые, по-видимому, формируются уже на уровне сетчатки. Для экспериментальной проверки этой гипотезы желательно использование так называемых «простых нервных систем», т. е. животных с предельно просто устроенной зрительной системой, которая способна различать градации яркости света, но не в состоянии дифференцировать цвет и форму объектов. Опыты на таких биологических моделях позволяют исследовать механизмы кодирования яркости (ахроматического зрения) изолированно от механизмов кодирования цвета и формы. В качестве такой «простой системы» рассмотрим зрительную систему легочного моллюска (Helix pomatia L., Helix lucorum L.). Ахроматическое зрение этого беспозвоночного, базирующееся на активности фотопигмента «родопсина», является аналогом «палочковой монохромазии» у позвоночных и может служить удобной экспериментальной моделью для изучения механизмов кодирования яркости света в «чистом виде» (Chernorizov et. al., 1994). Глаза виноградной улитки имеют типичное камерное строение (Wilbur, Yonge, 1966; Зайцева, 1992). Они располагаются в вершинах задних головных щупалец и иннервируются оптическим нервом. Каждый глаз имеет роговицу, хрусталик, стекловидное тело и однослойную сетчатку. Тщательные исследования ультраструктуры глаза Helix pomatia (виноградной улитки) (Зайцева, 1992) и ее ближайшего «родственника» — Helix asperca (садовой улитки) выявили три типа элементов: фоторецепторы, опорные и нервные клетки (Eakin, Brandenburger, 1967). Поскольку опорные клетки являются вспомогательными, а нейроны немногочисленны, то, по-видимому, основную информационную функцию в глазу моллюска выполняют фоторецепторы. На обращенной к свету апикальной части у них имеются микровиллярные структуры, в которых содержатся светочувствительные гранулы фотопигмента. Фоторецепторы глаза улитки являются «первично-чувствующими», т. е. генерирующими потенциалы действия. Помимо клеточного тела, они имеют длинные аксоны, обладающие спайкгенерирующим механизмом. Эти аксоны образуют оптический нерв и в его составе направляются в церебральные ганглии. Предположительно, основная функция фоторецепторов улитки состоит в локализации источника освещения при осуществлении фототропических реакций. Так, удаление глаз у Helix aspersa (садовые улитки) и у Otala lactea приводило к утрате животным характерного для них отрицательного фототропизма.
Основной задачей нашей работы была проверка гипотезы о том, что темновой и яркостной модули яркостной системы зрения формируются на уровне сетчатки глаза. С этой целью исследовались суммарная активность глаза (электроретинограмма, ЭРГ) и суммарная электрическая активность оптического нерва.
Методика
Препарат
Опыты проводились при температуре 18—200С на полуинтактном препарате виноградной улитки (Helix pomatia), включающем глаз, окологлоточное ганглионарное кольцо и оптический нерв, связывающий эти структуры. Темно-адаптированный (в течение 1 часа до начала опытов) препарат размещался в специальной ванночке в экранированной светоизолированной камере. Для поддержания жизнеспособности препарат был погружен в стандартный физиологический раствор для холоднокровных животных (мМ): 80 NaCl, 4 KCl, 8 CaCl2, 5 MgCl2, 4 Tris- HCl (pH 7.8) (Sokolov, Palikhova, 1999).
Стимулы
В качестве фотостимулятора использовали экран монитора компьютера. Стимулами служили гомогенные монохромные вспышки света различной длительности (от 100 мс до 3 с), яркости (в диапазоне от 2 кд/м2 до 75 кд/м2) и цвета. Интенсивность (яркость) световых стимулов измеряли яркомером-колориметром с ошибкой ±5%. В качестве цветовых стимулов использовали стандартные широкополосные излучения трех типов люминофоров цветного монитора: «синего люминофора» с доминирующей длиной волной 485 нм, «зеленого люминофора» с доминирующей длиной волны 530 нм и «красного люминофора» с доминирующей длиной волны 610 нм. Проекция стимулов с экрана монитора непосредственно на препарат осуществлялась через световод. Темновой межстимульный интервал, разделявший предъявление одиночных световых стимулов, составлял не менее 2 минут. Он определялся экспериментально в опытах с регистрацией электроретинограммы (ЭРГ) как минимальная длительность промежутка между последовательно предъявляемыми стимулами, обеспечивающая поддержание темнового уровня адаптации глаза моллюска.
Регистрация активности сетчатки и оптического нерва
Электроретинограмма регистрировалась монополярно при расположении активного электрода на хрусталике, а индифферентного — в физиологическом растворе, омывающем препарат. В качестве активного электрода использовалась стеклянная микропипетка (сопротивление кончика ~ 1 МОм), заполненная физиологическим раствором, а индифферентным служил серебряный неполяризующийся электрод. Регистрируемые сигналы подавались через каскад предварительного усилителя на осциллограф CI-103 и далее на 16-канальный аналого-цифровой преобразователь (частота опроса — 250 Гц) компьютера IBM Pentium I, где осуществлялась запись биопотенциалов в память с помощью специализированной программы регистрации и анализа данных «Conan» (Кулаичев, 2002).
Экстраклеточная регистрация мультипиковой спайковой активности оптического нерва осуществлялось в тех же условиях, что и регистрация ЭРГ, только в качестве активного электрода использовался стеклянный присасывающий к нерву электрод (диаметр кончика 30—40 мкм), заполненный насыщенным раствором КС1.
Обработка и представление данных
Обработка первичных электрофизиологических данных (отбраковка артефактов, фильтрация и усреднение записей) осуществлялась с помощью специализированной компьютерной программы «Conan» (Кулаичев, 2002). Дальнейший анализ данных и построение графиков производили с использованием статистического пакета STATISTICA-5.
Результаты
1. Данные регистрации и анализа ЭРГ
1.1. Зависимость ЭРГ глаза виноградной улитки от интенсивности и спектрального состава светового стимула.
Освещение глаза при достижении порогового уровня вызывает электрофизиологическую активность сетчатки, суммарно регистрируемую в виде электроретинограммы (ЭРГ). Электроретинограмма виноградной улитки, в отличие от ЭРГ позвоночных, включает всего лишь один компонент — роговично-позитивный компонент, латентность и амплитуда которого в наших экспериментах варьировала в пределах 2^3 с и 0.3 -н 0.9 мВ, соответственно (рисунки 1—3). На рисунке 1 изображены функции зависимости пиковой амплитуды ЭРГ от интенсивности синего (доминирующая длина волны 485 нм), зеленого (доминирующая длина волны 530 нм) и красного (доминирующая длина волны 610 нм) цветовых стимулов фиксированной длительности (3 с). Видно, что сетчатка виноградной улитки наиболее чувствительна к изменениям интенсивности стимулов синего цвета: амплитуды ЭРГ при излучении синего цвета заметно превышают амплитуды ЭРГ при зеленых и красных стимулах, реакции на синий цвет быстрее достигают насыщения и обладают минимальным нижним порогом, равным в условиях наших опытов 1 кд/м2.
Рисунок 1. Графики зависимости пиковой амплитуды ЭРГ от интенсивности и спектральных характеристик стимуляции
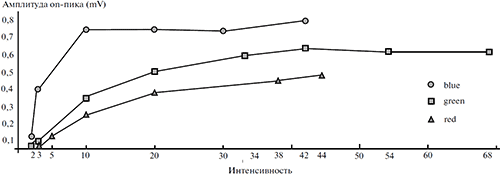
Данные получены при использовании в качестве стимулов широкополосных излучений синего (Blue), зеленого (Green) и красного (Red) цветов фиксированной длительности (3 с). По оси абсцисс – значения фотометрической яркости стимулов (кд/м2), по оси ординат – максимальное (пиковое) значение амплитуды ЭРГ (mV).
Видно также, что с изменением интенсивности света амплитуда ЭРГ меняется нелинейно. При увеличении интенсивности от 1 кд/м2 до 3.5 кд/м2 амплитуда ЭРГ нарастает быстрее, чем в интервале от 3.5 кд/м2 до 10 кд/м2. После 10 кд/м2 рост амплитуды реакции еще более замедляется, и при значениях свыше 45 кд/м2 значения функции достигают «плато насыщения». Таким образом, область различения яркости света глазом виноградной улитки ограничена диапазоном 1-н 45 кд/м2.
1.2. Зависимость ЭРГ виноградной улитки от длительности светового стимула.
В целях дальнейшего анализа свойств суммарной электрической активности глаза улитки использовались синие стимулы фиксированной яркости (7.5 кд/м2) и переменной длительности (3 с, 5 с, 10 с и 20 с). Примеры записей соответствующих реакций приведены на рисунке 2.
Рисунок 2. Зависимость формы ЭРГ виноградной улитки от длительности стимуляции (3 с, 5 с, 10 с, 20 с) излучениями синего цвета
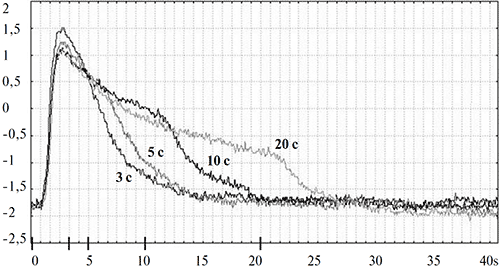
По оси абсцисс – время (с) от момента предъявления стимула (0 с) до завершения регистрации ЭРГ-ответа (40 с); по оси ординат – амплитуда реакции (мВ).
На рисунке 2 видно, что главной составляющей ЭРГ-реакции является позитивный пик, «привязанный» к моменту включения стимула. В соответствии с общепринятой классификацией световых реакций, предложенной H.K. Hartline (1940), мы обозначили этот пик как «on»-пик, или «юп»-реакция (от англ. «onset» — включение). Латентный период, амплитуда и форма переднего фронта «on»- пика не зависят от длительности используемых стимулов. За ««да-ответом следует фаза медленного затухания реакции. Отчетливо проступает зависимость длительности этой фазы реакции от длительности стимула: она возрастает при увеличении длительности стимуляции. Очевиден еще один эффект влияния длительности световой стимуляции на конфигурацию ЭРГ- ответа: при увеличении длительности засвета на заднем фронте реакции появляется перегиб, после которого процесс затухания ответа до исходного уровня заметно ускоряется.
Характерным отличием ЭРГ улитки от ЭРГ позвоночных животных является то, что при любой длительности (и интенсивности) стимуляции в ЭРГ улитки отсутствует реакция на выключение света («off» -реакция). Эта специфика продемонстрирована на рис. 3, где для сравнения приведены записи ЭРГ виноградной улитки и лягушки, регистрировавшиеся в идентичных условиях. На нем видно, что, в отличие от виноградной улитки, ЭРГ лягушки, как и других позвоночных, имеет выраженный не только «on»-, но и «off»- компонент.
Рисунок 3. ЭРГ виноградной улитки (а) и лягушки (б) на диффузную вспышку одинаковых цвета (зеленого), интенсивности (10 кд/м2) и длительности (8 с)
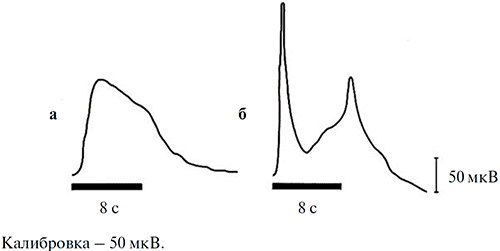
2. Светоиндуцированная активность оптического нерва виноградной улитки
Оптический нерв соединяет сетчатку глаза виноградной улитки с церебральными ганглиями ее ганглионарной нервной системы (Зайцева, 1992). При этом отдельные волокна зрительного нерва представлены, главным образом, отростками фото-рецепторных клеток. Своеобразие фоторецепторов улитки, относимых к типу так называемых «первично-чувствующих рецепторов» (Винников, 1971), состоит в том, что они, в отличие от «вторично-чувствующих» фоторецепторов позвоночных, обладают способностью к генерации потенциалов действия. В темноте оптический нерв виноградной улитки не активен, а на освещение глаза отвечает мультипиковым разрядом, представленным потенциалами действия разной амплитуды.
В наших опытах проводилась одновременная регистрация ЭРГ и потенциалов действия оптического нерва. Пример такой одновременной записи приведен на рисунке 4.
Рисунок 4. Одновременная регистрация спайковой активности оптического нерва и ЭРГ при предъявлении светового стимула на фоне темновой адаптации
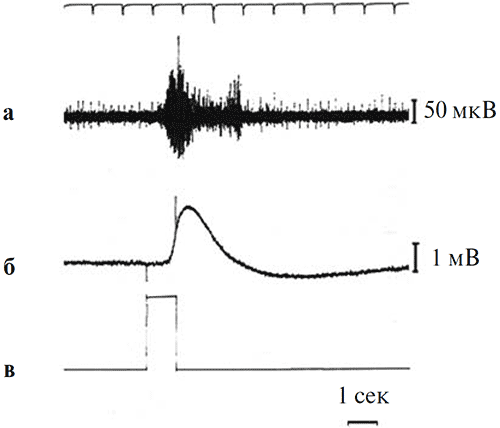
а – ответ оптического нерва, б – ЭРГ, в – отметка стимула. Калибровка: 1 мВ для ЭРГ, 50 мкВ для оптического нерва. Отметка времени – 1 с. Верхняя линия на рисунке – шкала времени с фиксированным шагом 1 с.
Из записей, аналогичных приведенным на рисунке 4, следует, что латентный период ЭРГ-реакции превышает латентный период реакции оптического нерва на 200 мс. Величина этого «временного лага» остается неизменной и при увеличении интенсивности стимулов, когда значения латентности каждого из обоих типов ответов закономерно снижаются (рисунок 5).
Рисунок 5. Зависимость латентных периодов ЭРГ и реакции оптического нерва от интенсивности светового раздражения
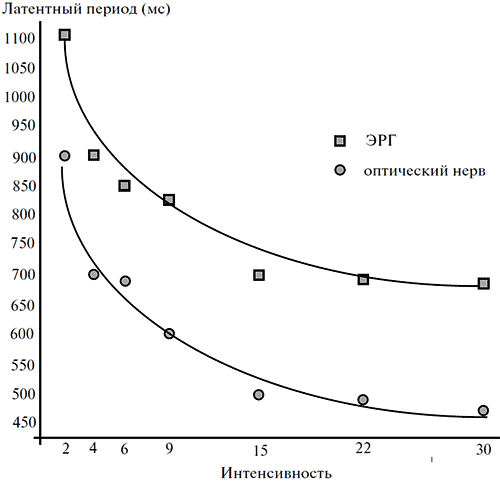
Стимул: синий цвет длительностью 1 с. По оси абсцисс – значение фото_ метрической яркости стимула (кд/м2), по оси ординат – латентный период реакций (мс).
Анализ свето-индуцированных ответов оптического нерва показывает, что, в отличие от ЭРГ, суммарная реакция на свет оптического нерва двухфазна, т. е. представлена двумя вспышками спайковых разрядов, разделенными интервалом относительно низкой активности (рисунок 4). Первая фаза этого ответа так же, как и вышеописанный «on»-компонент в составе ЭРГ, связана с включением светового стимула и, в соответствии с принятой нами терминологией, может быть обозначена как «on»-реакция зрительного нерва на свет. Второй всплеск спайковой активности оптического нерва совпадает по времени с моментом возвращения ЭРГ-реакции к фоновому уровню темновой адаптации (рисунок 4).
Если «on»- компонент реакции оптического нерва очевидным образом является реакцией на включение света, то для выяснения связи второй фазы с параметрами стимуляции потребовались дополнительные опыты. В этих опытах проверялось следующее предположение: вторая фаза ответа оптического нерва является реакцией на выключение светового стимула, т.е. «off» - реакцией. В ходе ее проверки изучалась зависимость между временем появления второй фазы ответа оптического нерва и моментом выключения света в условиях варьирования длительности стимуляции. В результате было обнаружено, что увеличение длительности фиксированного по интенсивности светового стимула от 100 мс до 36 с ожидаемым образом приводит к возрастанию латентного периода второй фазы спайковой активности оптического нерва (рисунки 6, 7).
Рисунок 6. Одновременная регистрация реакций оптического нерва (а) и ЭРГ (б) на световые стимулы разной длительности
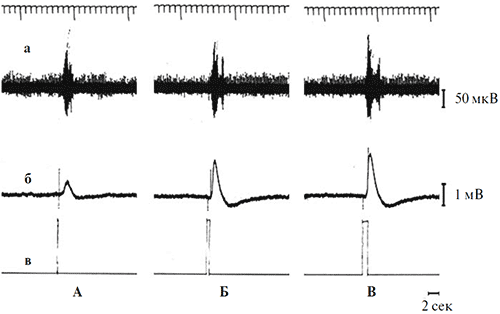
Параметры стимуляции (отметка в): синий цвет фиксированной интенсивности (7.5 кд/м2) и разной длительности (А – 100 мс, Б – 500 мс, В – 1 с). Калибровка: 1 мВ для ЭРГ, 50 мкВ для оптического нерва. Отметка времени – 2 с. Верхняя линия на рисунке – шкала времени с фиксированным шагом 1 с.
Рисунок 7. Влияние длительного (31 с) освещения на выраженность «on»9 «off»9 компонентов в реакциях оптического нерва (а) и ЭРГ (б).
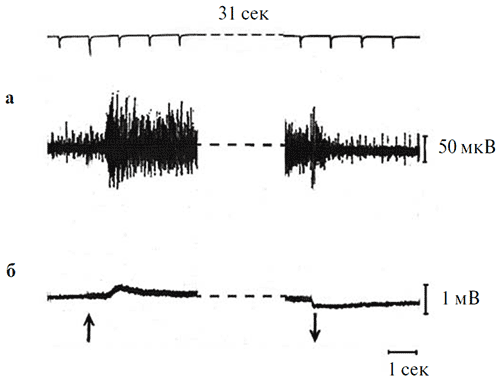
Параметры стимуляции: синий цвет (7.5 кд/м2). Калибровка: 1 мВ для ЭРГ, 50 мкВ для оптического нерва; отметка времени – 1 с. Стрелками показаны момент включения и выключения стимула. Верхняя линия на рисунке – шкала времени с фиксированным шагом 1 с.
Обсуждение
Представленное исследование суммарной активности сетчатки (ЭРГ) и оптического нерва свидетельствует о том, что периферическая часть зрительной системы виноградной улитки способна различать достаточно малые перепады в интенсивности освещения. При этом выяснилось, что максимум яркостной дифференциальной чувствительности приходится на область синих цветов. Это находится в полном соответствии с тем фактом, что фоторецепторы улитки содержат только один фотопигмент — родопсин, оптимум поглощения которого приходится на сине-зеленую область видимого спектра с пиком на 490—500 нм (Von Berg, Shneider, 1972; Черноризов и др., 1992).
Другим фактором, характеризующим чувствительность виноградной улитки к свету, является нелинейность зависимости между интенсивностью светового сигнала и величиной ответной реакции сетчатки. Так, при увеличении интенсивности света от 1 кд/м2 до 3.5 кд/м2 амплитуда ЭРГ нарастает быстрее, чем в интервале от 3.5 кд/м2 до 10 кд/м2. Далее процесс роста ЭРГ еще более замедляется и достигает плато. Такая зависимость, очевидно, позволяет виноградной улитке обнаруживать самые незначительные изменения в области экологически значимых для этого вида небольших значений освещения и игнорировать различия в области больших значений яркости. Экологическая адаптивность (специализация) подобного рода является одним из общих законов функционирования всех сенсорных систем (Кейдель, 1975).
Освещение глаза виноградной улитки вызывает ответную электрическую активность сетчатки, интегрально регистрируемую в виде электроретинограммы (ЭРГ) (Шехтер и др., 1992). Эта реакция представляет собой роговично-позитивное отклонение, характеризующееся большим латентным периодом и довольно медленной скоростью нарастания (передний фронт) и спадания (задний фронт) сигнала. Такая структура ЭРГ-ответа виноградной улитки сходна с аналогичными реакциями у других видов моллюсков (Жуков, Грибакин, 1990; Шарко и др., 1973; Gillary, 1970).
Какие же клеточные структуры являются источником ЭРГ виноградной улитки? У позвоночных животных логарифмическая зависимость величины реакции от интенсивности света наблюдается уже на фоторецепторном уровне (Смит, 2005). В пользу фоторецепторного происхождения ЭРГ виноградной улитки свидетельствует ее форма, напоминающая форму внутриклеточной реакции отдельного фоторецептора (Brown, Flaming, 1977). ЭРГ с такой же простой формой можно зарегистрировать и от глаза со сложной сетчаткой (например, кошки), если с помощью определенных воздействий исключить работу клеток внутреннего ядерного слоя, сохранив нормальное функционирование фоторецепторов (Brown, 1968).
Унифицированные в отношении зрительного пигмента фоторецепторы виноградной улитки, однако, неоднородны как морфологически, так и функционально. Морфологически, по размерам микровиллярного аппарата, фоторецепторы сетчатки улитки делят на два типа: рецепторы первого типа, характеризующиеся большим размером микровиллярного аппарата и доминирующие в сетчатке (до 3800 клеток) и немногочисленные (75—200 единиц) фоторецепторы второго типа, несущие короткие и нерегулярные микровиллы (Eakin, Brandenburger, 1967). Функционально фоторецепторы виноградной улитки также неоднородны, поскольку одна их часть реагирует на освещение де- поляризационным, а другая — гиперполяризационным смещением фонового (темнового) уровня мембранного потенциала. Поскольку этот результат получен не только на интактной сетчатке (Черноризов и др., 2007; Chernorizov, Sokolov, 2010), но и при исследовании полностью изолированных клеток, лишенных синаптических контактов, можно утверждать, что разнонаправленность фоторецепторных ответов (как де-, так и гипер-) у виноградной улитки обусловлена эндогенно, т. е. свойствами самих фоторецепторов (Шехтер, Греченко, 2009).
Несмотря на то, что потенциалы отдельных фоторецепторов виноградной улитки имеют противоположную полярность (де- или гиперполяризация), суммарный электрический ответ ее сетчатки «монополярен» и состоит только из одного роговично-позитивного колебания. Это может быть объяснено следующим образом. Латентный период световых реакций у обоих типов фоторецепторов одинаков, но реакции гиперполяризационного типа характерны для относительно небольшой части фоторецепторов: по нашим данным, этот тип ответов демонстрируют только около 28% клеток от общего числа обследованных элементов (Шехтер, Греченко, 2009). Как следствие, в интегральной форме (ЭРГ) активность этого типа клеток может маскироваться активностью доминирующих в сетчатке фоторецепторов, гиперполяризующихся светом. Можно предположить, что фоторецепторы этих двух типов представляют собой «яркостные» (возбуждаемые светом, деполяризующиеся) и «темно- вые» (тормозимые светом, гиперполяризующиеся) элементы сетчатки. Тогда отсутствие проявлений «off»-эффекта (эффекта выключения света) в ЭРГ виноградной улитки объясняется не отсутствием «темновой системы» в сетчатке, а ее «маскировкой» активностью «яркостной» системы.
Еще одной особенностью фоторецепторных клеток виноградной улитки является совмещение собственно рецепторной функции и функции первичного сенсорного нейрона, поскольку их аксоны обладают спайк- генерирующим механизмом. Эти аксоны образуют оптический нерв и в его составе уходят в ЦНС. Оптический нерв содержит несколько популяций волокон, которые различаются по диаметру и, как следствие, скорости проведения электрического сигнала (Зайцева, 1992). Световая стимуляция глаза вызывает асинхронную активность этих волокон, представленную в суммарной активности оптического нерва потенциалами действия разной амплитуды (рисунки 6, 7).
При включении света появление потенциалов действия в оптическом нерве опережает электроретинограмму. Факт отставания фоторецепторной реакции от реакции морфологически более удаленной структуры свидетельствует о присутствии в сетчатке виноградной улитки глиальных клеток, опосредующих реакции фоторецепторов. Активность этих медленно срабатывающих «глиальных буферов», по- видимому, и приводит к задержке ЭРГ-проявлений деятельности собственно информационных элементов сетчатки (фоторецепторов и нейронов). В этом отношении ЭРГ виноградной улитки сходна с ЭРГ позвоночных, являющейся непосредственным отражением реакций Мюллеровских глиальных клеток сетчатки (Черноризов, 2008).
В отличие от ЭРГ, в светоиндуцированной активности оптического нерва присутствуют как «on» -ответ на включение света, так и «off» - разряд, следующий за ним. Эти реакции, по-видимому, принадлежат разным популяциям нервных волокон, поскольку представлены потенциалами действия разной амплитуды (рис. 6, 7). Если для «on» - ответа характерны относительно высокоамплитудные потенциалы действия (ПД), то в «off» - реакцию вовлечены низкоамплитудные ПД. Кроме того, по сравнению с «on» - ответом «off» - реакция менее выражена, что говорит об относительно небольшом числе волокон, реагирующих на выключение освещения. Это позволяет соотнести происхождение «off - ответа оптического нерва с деятельностью малочисленных фоторецепторов, гиперполяризующихся светом и, соответственно, деполяризующихся его выключением (это и есть «off» - реакция).
Таким образом, есть экспериментальные основания утверждать, что в ахроматической зрительной системе виноградной улитки «яркостная» и «темновая» подсистемы начинают складываться уже на уровне фоторецепторов. Не исключено, что в их окончательном формировании принимают участие и вставочные нейроны в нейропиле у основания оптического нерва, где, кроме того, обнаружены связи между коллатералями самих фоторецепторов (Зайцева, 1992).
В зрительных системах животных, сетчатка которых значительно сложнее, чем сетчатка виноградной улитки, «яркостный» и «темновой» каналы формируются не на рецепторном, а на более высоком клеточном уровне. В частности, у рыб проявление активности этих каналов впервые обнаруживается в слое биполярных клеток сетчатки (Черноризов, 1999; Черноризов, Соколов, 2001). С другой стороны, у более примитивного, чем виноградная улитка, моллюска Onchidium яркостная и темновая системы не объединены в сетчатке, а распределены по двум морфологически разным органам зрения. Его яркостное различение обеспечивают цефалические глаза, а дорзальные глаза, расположенные на нижней поверхности тела Onchidium, вовлечены в теневой ответ (Katagiri Y., Katagiri N., Fujimoto K., 1985).
Заключение
Зрительные системы человека и разных животных могут использовать разные «тактические приемы» для формирования «яркостного» и «тем- нового» модулей: у позвоночных эти модули формируются на уровне нейронов сетчатки (начиная с биполяров), а у беспозвоночных уже на уровне фоторецепторов. Однако сам принцип оппонентности в функционировании механизмов зрения, предполагающий взаимодействие в реакциях на свет «темнового» и «яркостного» модулей, по-видимому, универсален для позвоночных и беспозвоночных животных. Наши собственные данные и анализ литературы свидетельствуют в пользу того, что нейронной основой различения яркости является согласованная («взвешенная») активность «on» - и «off» - каналов зрительной системы.
Список литературы:
-
Батуев А.С., Куликов Г.А. Введение в физиологию сенсорных систем. — М.: Высшая школа, 1983.
-
Винников Я.А. Цитологические и молекулярные основы рецепции. — Л.: Наука, 1971.
-
Жуков В.В., Грибакин Ф.Г. Спектральная чувствительность глаза моллюсков в ультрафиолетовой и видимой области спектра // Сенсорные системы. — 1990. — Т. 4. №4. - С. 341-350.
-
Зайцева О.В. Структурная организация сенсорных систем улитки // Журнал ВНД им. И.П. Павлова. - 1992. - Т. 42(6). - С. 1132-1150.
-
Зимачев М.М., Шехтер Е.Д., Соколов Е.Н., Измайлов Ч.А. Хроматическая составляющая электроретинограммы лягушки // Журн. ВНД им. И.П. Павлова. - 1986. - Т. 36 (6). - С. 1100-1107.
-
Измайлов Ч.А., Зимачев М.М., Соколов Е.Н., Черноризов А.М. Двухканальная модель ахроматического зрения лягушки // Сенсорные системы. - 2006. - Т. 20 (1) - С. 1-11.
-
Измайлов Ч.А., Исайчев С.А., Шехтер Е.Д. Двухканальная модель различения сигналов в сенсорных системах // Вестник Моск. ун-та. Серия 14 «Психология». - 1998. - №3. - С. 29-40.
-
Измайлов Ч.А., Соколов Е.Н. Цветовое зрение. -М.: МГУ, 1984.
-
Кейдель В.Д. Физиология органов чувств. М.: Медицина, 1975.
-
Кулаичев А.П. Компьютерная электрофизиология. - М.: Изд-во МГУ, 2002.
-
Николс Дж. Г., Мартин А.Р., Валлас Б.Дж., Фукс П.А. От нейрона к мозгу. - М.: УРСС, 2003.
-
Смит К. Биология сенсорных систем. - М.: БИНОМ, 2005.
-
Соколов Е.Н. Восприятие и условный рефлекс. Новый взгляд. - М.: УРСС, 2003.
-
Фомин С.В., Соколов Е.Н., Вайткявичус Г.Г. Искусственные органы чувств. - М.: Наука, 1979.
-
Черноризов М.М. Нейронные механизмы цветового зрения: Автореферат докт. дис. М.: МГУ, 1999.
-
Черноризов А.М. Глия: морфология, физиология, функции // Нейрон / Под ред. Соколова Е.Н., Филиппова В.А., Черноризова А.М. - Тюмень, 2008. - С. 433-467.
-
Черноризов А.М., Соколов Е.Н. Векторное кодирование цвета в слое биполярных клеток сетчатки карпа // Вестник МГУ. Серия 14. «Психология». - 2001. - №1. - С. 12-33.
-
Черноризов А.М., Шехтер Е.Д., Греченко Т.Н., Гарусев А.В. Психофизиология ахроматического зрения: от простых нервных систем к человеку // Психология человека в современном мире. - Т. 4. - 2009. - С. 370-377.
-
Шарко Н.В., Осипов Б.С., Ежков А.Р. Электрические ответы глаза моллюска Lymnaea stagnalis // Теоретическая и экспериментальная биофизика. - 1973. - Вып. 4. - С. 141-146.
-
Шехтер Е.Д., Зимачев М.М., Аракелов Г.Г. Зрение виноградной улитки. Морфология и суммарная электрическая активность сетчатки // Журнал ВНД им. И.П. Павлова. - 1992. - Т. 42 (5). - С. 986-991.
-
Шехтер Е.Д., Греченко Т.Н. Два типа фоторецепторов в ахроматической зрительной системе виноградной улитки // Экспериментальная психология. - 2009. - №2(2). - С. 5-15.
-
Brown K.T., Flaming D.G. Intracellular recording in outer segments of red and green rods of the toad // Society for Neuroscience Abstracts. - 1977. - №3. - Р. 554.
-
Brown K.T. The electroretinogram: its components and their origins // Vision Res. 1968. - Vol. 8 (6). - P. 633-677.
-
Chernorizov A.M., Shekhter E.D., Arakelov G.G., Zimachev M.M. The Vision of the Snail: The Spectral Sensitivity of the Dark- Adapted Eye // Neurocsi. & Behav. Physiol. 1994. - Vol. 24 (1). - P. 59-62.
-
Chernorizov A.M., Sokolov E.N. Mechanisms of achromatic vision in invertebrates and vertebrates: A comparative study // Spanish J. Psychology - 2010. - Vol. 13 (1). P. 18-29.
-
Dartnall H.J.A. The interpretation of spectral sensitivity curves // Br. Med. Bull. - 1953. - №9. - P. 24-30.
-
Gillary H.L. Electrical responses from the eye of Helix to photic stimulation and simultaneous electrical stimulation of the optic nerve // Vision Res. - 1970. - Vl. 10 (10). P. 977-991.
-
Hartline H.K. The nerve messages in the fibers of the visual pathway // J. Opt. Soc. Am. - 1940. - Vol. 30. - P. 239-247.
-
Heggelund P. Achromatic color vision. I. Perceptive variables of achromatic colors // Vision Res. - 1974. - Vol. 14. - P. 1071-1079.
-
Eakin R.M., Brandenburger J.l. Differentiation in the eye of a pulmonate snail Helix aspersa // J. Ultrastruct. Res. - 1967. - Vol. 18 (4). - P. 391-421.
-
Izmailov Ch.A., Sokolov E.N. Spherical model of color and brightness discrimination // Psychologic. Science. - 1991. - №2. - P. 249-259.
-
Katagiri Y., Katagiri N., Fujimoto K. Morphological and electrophysiological studies of a multiple photoreceptive system in a marine gastropode Onchidium // Neuroscience Research. - 1985. - Vol. 2. - P. 1-15.
-
Sokolov E.N., Palikhova T.N. Immediate plasticity of identifiable synapses in the land snails Helix lucorum // Acta Neurobiol. Exp. 1999. - Vol. 59. - P. 161-169.
-
Von Berg E., Shneider G. The spectral sensitivity of the dark-adapted eye of Helix pomatia // Vision Res. - 1972. - Vol. 12 (12). P. 2151-2152.
- Wilbur K.W., Yonge C.M. (Eds.) Physiology ofmollusca. -Academic Press: New York and London. V. II., 1966.
Шехтер М.С., Черноризов А.М., Гадельшина Д.Ф.Модульная организация механизмов ахроматическо зрения: от человека к простым нервным системам. // Национальный психологический журнал. 2010. № 2. , 92-99. doi:
Скопировано в буфер обмена
Скопировать

